火电厂凝结水精处理系统离子交换器酸碱再生废水中含较高浓度的氨氮,总溶解固形物以钠离子、氯离子为主,二价结垢性离子含量很低,采用反渗透技术回收再生废水中的淡水后,浓水中主要含氯化钠、氨氮及少量杂质离子。电厂凝汽器冷却水系统中通常需要加氯以控制微生物的繁殖,因而电解食盐水、海水制氯设备在电厂中应用广泛,为了利用上述反渗透浓水中的氯化钠资源,考虑将其回用于电解制氯系统。然而,高浓度氨氮在电解过程中的去除性能及其对制氯过程的影响,需通过试验确定。
钛金属基体表面涂覆铂族金属氧化物涂层电极,是一种具有电催化活性的尺寸稳定型阳极,简称DSA(Dimensionally Stable Anode)阳极。自20世纪60年代末发明后,DSA阳极在化工、氯碱、电镀、冶金、电解水、阴极保护等各行业中得到广泛应用。以RuO2、IrO2等为涂层的DSA阳极的析氯催化活性高,被大量应用于电解制氯设备中。另一方面,利用DSA阳极的电催化活性氧化降解废水中的氨氮也受到了广泛关注。在垃圾渗滤液处理、化肥厂废水处理、炼油厂废水处理、养猪废水处理、榨菜废水处理、制革废水处理等研究中,电化学氧化对废水中的氨氮、COD的去除率及影响因素得到了讨论,结果表明,不同水质、不同DSA阳极和不同工艺参数条件下,氨氮的降解速率、能耗等有较大差异。本研究根据电厂用电解制氯设备的技术要求,优选适当的DSA阳极,考察pH、电流密度、TDS、极板清洗等因素对电解除氨氮及制氯过程的影响,以期为DSA阳极的工业应用提供参考。
1、试验材料与方法
1.1 试验水质
试验所用水样为模拟水样和反渗透浓水两种,模拟水样是按电厂凝结水精处理系统酸碱再生废水反渗透回收现场试验的浓水水质配制而成,反渗透浓水则取自现场试验的浓水,主要水质见表 1。
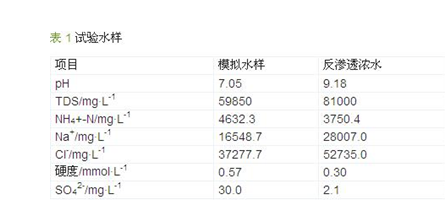
由水质分析数据可见,试验水样含盐量很高,硬度、硫酸根等含量很低,主要离子成分是Na+和Cl-,氨氮含量很高。
1.2 试验材料及装置
1.2.1 DSA阳极电化学试验
结合工业用电解制次氯酸钠设备的性能特点及使用的主要阳极材料,选择4种不同涂层配方的DSA阳极(编号R1~R4)进行电化学试验。其中,R1、R2为钛基钌铱氧化物(Ti/RuO2-IrO2)涂层DSA,R3、R4为钛基铱钽氧化物(Ti/IrO2-Ta2O5)涂层DSA。电化学试验用电解液为:饱和氯化钠溶液(测析氯电位)、0.5 mol/L H2SO4溶液(测析氧电位)。
将试验用待测DSA阳极加工成样片,接线、封装成有效面积为1 cm2的工作电极,辅助电极为大面积钛片,参比电极选用饱和甘汞电极和汞-硫酸亚汞电极,分别用于析氯电位测定和析氧电位测定。
1.2.2 电解试验
自制有效容积为2 L的水浴电解槽,将试验用DSA电极加工成尺寸为100 mm×100 mm的极板,共7片。将7片电极串联放入电解槽,极板与极板的间距为10 mm,首、末极板与开关直流电源的正、负极相连,电解槽内水样采用磁力搅拌器实现均匀搅拌。
1.3 试验方法
DSA阳极电化学试验方法:采用线性伏安扫描法测定阳极过电位。试验采用三电极电化学体系。测试时采用水浴恒温,以待测DSA阳极为工作电极,钛片为辅助电极,饱和甘汞电极、汞-硫酸亚汞为参比电极。为了降低溶液电位差,使用鲁金毛细管加参比电极测量工作电极电位。设定扫描速率为5 mV/s,进行线性伏安曲线测定,求得析氯、析氧电位。
电解试验方法:试验过程中采用恒电流电解,分别控制电流密度为100、130、200 mA/cm2进行试验。每次电解的水样为2 L(水样为模拟水样和反渗透浓水),电解槽放入恒温水浴,控制反应温度在30 ℃以下。试验期间每15 min取样1次,测定水样氨氮、总氯、游离氯、Cl-。根据测定结果分析电流密度、TDS、pH、极板清洗等因素对电解除氨氮及制氯过程的影响。
1.4 仪器和分析方法
分析仪器:SG23便携式pH/电导率多参数测试仪,梅特勒•托利多公司;Specord 210紫外-可见分光光度计,德国耶拿公司;Zeenit-700原子吸收光谱仪,德国耶拿公司;LK2010电化学工作站,兰力科公司;玻璃水浴电解池,定制;鲁金毛细管、饱和甘汞电极、Hg/Hg2SO4电极,定制;磁力搅拌器,雷磁公司;开关直流电源,30V/50A。
分析方法:电导、pH,便携式多参数水质分析仪;Na+,原子吸收光谱法;Cl-,硝酸银滴定法;NH4+-N,纳氏试剂分光光度法;硬度,EDTA滴定法;TDS,重量法;总氯、游离氯,硫酸亚铁铵滴定法。
2、结果与讨论
2.1 DSA阳极析氯、析氧电位测定结果
在废水电解过程中氨氮的去除有两种途径:直接电化学氧化和间接电化学氧化。直接电化学氧化是氨氮在阳极表面直接被氧化去除,或被阳极电化学反应生成的羟基自由基氧化生成氮气去除;而间接电化学氧化主要指氨氮被电解生成的有效氯氧化成氮气去除,当溶液中含氯离子时,氨氮电化学氧化的主要途径是间接氧化。因此,在本研究的水质条件下,优选的DSA电极应具有良好的制氯性能,以提高电解对废水中氨氮的去除效果。根据电化学反应原理,在电解制氯过程中,DSA阳极上发生的析氧反应是析氯反应的主要竞争副反应,DSA阳极上发生的析氧反应越少,越有利于析氯反应。对预选的4种DSA阳极进行了析氯、析氧电位测定,并均换算为相对于饱和甘汞电极的电位,结果见表 2。
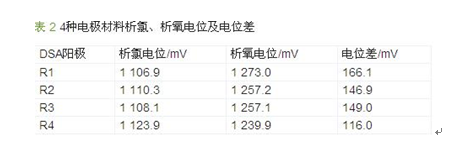
从析氯、析氧电位测定结果可知,4种阳极材料的析氧电位相差不大,析氯电位也差异较小,析氯电位均满足《电解海水次氯酸钠发生装置技术条件》(GB/T 22839—2010)中对阳极析氯电位的技术要求。相对来说Ti/RuO2-IrO2材料R1、R2电极析氧电位略高,析氯电位略低,析氧析氯电位差略大,用于电解除氨氮和制氯是较好的选择。从两类电极材料性能特点看,Ti/IrO2-Ta2O5电极使用了更贵的Ta2O5化合物,其耐腐蚀性较Ti/RuO2-IrO2电极更好,但价格贵近一倍。在R1、R2两种电极中进行比选,虽然R1的电位数据略优于R2,但其差异很小,考虑到R2电极材料更容易获得,选择Ti/RuO2-IrO2 (R2)材料作为后续电解试验用电极材料。
2.2 电流密度对氨氮降解及制氯的影响
在电流密度100、130、200 mA/cm2条件下,对反渗透浓水进行了电解试验,结果见图 1、图 2。
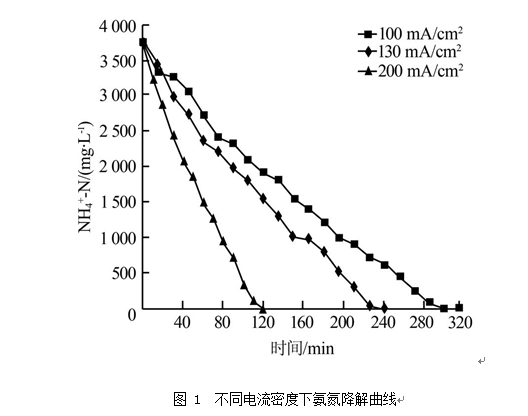
由图 1可见,不同电流密度下,氨氮浓度随电解时间呈近似线性下降,电流密度越大,氨氮去除速率越快。在电流密度100、130、200 mA/cm2条件下,分别电解300、240、120 min左右可将氨氮完全去除。同时通过考察不同电流密度下的电解能耗(以去除单位质量氨氮计算,下同)可知,在氨氮降解过程中,平均能耗随时间逐渐上升,且高电流密度能耗略高于低电流密度能耗,电解末期平均能耗在0.091~0.098 kW•h/g。
由图 2可见,不同电流密度下,溶液中总氯质量浓度变化趋势相似,由电解初期的约1 000 mg/L左右缓慢上升到电解末期的2 000 mg/L左右。当氨氮完全去除后,继续短时间电解,溶液中总氯快速上升,达到5 000 mg/L以上。这说明当溶液中存在氨氮时,电解产生的氯将主要被氨氮消耗。进一步分析总氯中游离氯、化合氯比例随电解时间的变化可知,在电解除氨氮过程中,不同电流密度下游离氯占总氯比例均在20%左右,当氨氮完全去除后,继续短时间电解,游离氯比例迅速上升至100%。这符合有氯离子存在条件下,氨氮的电化学氧化首先生成氯胺,再进一步氧化生成氮气的氨氮间接电化学氧化途径。
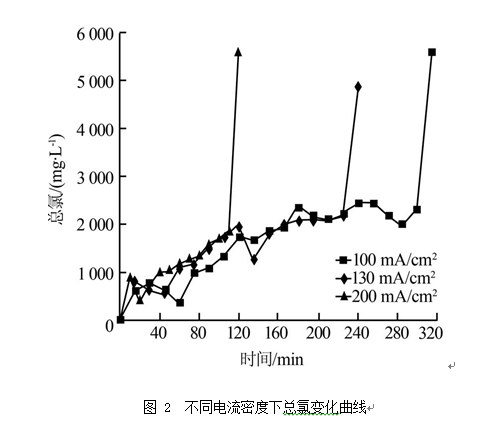
图 2 不同电流密度下总氯变化曲线
2.3 TDS对氨氮降解及制氯的影响
在电流密度200 mA/cm2、调整水样pH=7.05的条件下,对模拟水样和反渗透浓水(不同TDS)进行电解试验,结果见图 3、图 4。
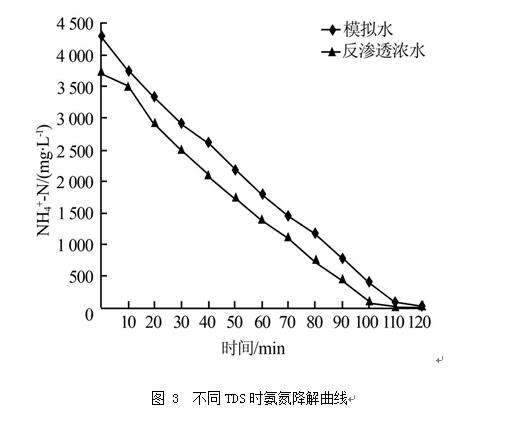
由图 3可见,相同电流密度、不同TDS条件下,溶液中氨氮浓度随电解时间近似线性下降,且氨氮的降解速率基本相等。由于试验所用高TDS的反渗透浓水的初始氨氮浓度较低,氨氮完全去除时间相对更短,电解110 min后基本去除完全。通过考察不同TDS时电解能耗变化可知,氨氮降解过程中,平均能耗随时间逐渐上升,水样TDS越高,氨氮降解的平均能耗相对越低。在TDS为59 850 mg/L(模拟水)时,电解末期平均能耗0.090 kW•h/g;TDS为81 000 mg/L(反渗透浓水)时,电解末期平均能耗0.078 kW•h/g。
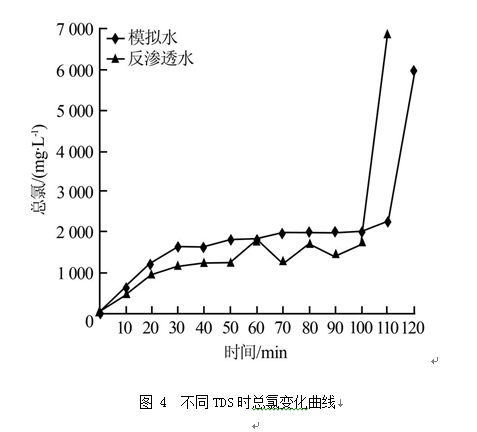
对不同TDS浓度的水样,溶液中总氯浓度随电解时间变化趋势相似。由图 4可见,电解前30 min,总氯质量浓度上升至1 000 mg/L以上,继续电解,总氯质量浓度缓慢上升至2 000 mg/L左右。此后,氨氮降解完毕,总氯质量浓度迅速上升至6 000 mg/L以上。不同TDS条件下,电解过程中游离氯占总氯比例稳定在20%左右,氨氮完全去除后,游离氯迅速上升至100%
2.4 pH对氨氮降解及制氯的影响
在电流密度200 mA/cm2、调整水样pH分别为7.05、9.18的条件下,对反渗透浓水进行电解试验,结果表明,相同电流密度、不同pH条件下,氨氮的降解速率相近。在pH=7.05时氨氮降解略快,110 min即可去除完全,电解末期平均能耗0.078 kW•h/g;而pH=9.18氨氮降解完全需120 min,电解末期平均能耗0.091 kW•h/g。即pH=7.05时氨氮降解的平均能耗低于pH=9.18时。实验结果还表明,水样的pH对电解过程中溶液总氯浓度的变化影响不大。整个电解过程中,总氯质量浓度缓慢上升至2 000 mg/L左右,待氨氮降解完毕后,继续电解,总氯质量浓度迅速上升至5 500 mg/L以上。不同pH时,溶液中游离氯占总氯比例相近,在10%~30%,氨氮完全降解后,总氯与游离氯相等。
2.5 极板清洗对氨氮降解及制氯的影响
在电流密度200 mA/cm2、pH=9.18条件下,分别采用化学清洗前、后的极板,对反渗透浓水进行电解试验,结果见图 5、图 6。其中极板清洗采用5%稀盐酸浸泡,时间5 min。

由图 5可见,极板清洗前、后氨氮的降解速率差异较大,极板清洗后氨氮降解速率较快,电解120 min可将氨氮完全去除,而相同时间内清洗前的极板对氨氮的去除率仅有77.7%。这说明极板表面的污染、结垢会降低DSA阳极涂层的电催化活性,对电解除氨氮影响很大。通过考察极板清洗前后电解能耗变化可知,极板清洗后的电解平均能耗低于清洗前。极板清洗前,电解末期平均能耗0.119kW•h/g,极板清洗后,电解末期平均能耗0.091kW•h/g。
由图 6可见,电解过程中溶液中总氯缓慢上升至2 000 mg/L左右,到120 min时,清洗后的极板已将氨氮完全去除,总氯质量浓度上升至5 600 mg/L,而清洗前的极板未出现总氯浓度快速上升的拐点。极板清洗前后,溶液中游离氯占总氯的比例均在20%左右,清洗后的极板将氨氮完全降解后,溶液中的总氯均以游离氯形态存在。
2.6 氨氮降解动力学分析
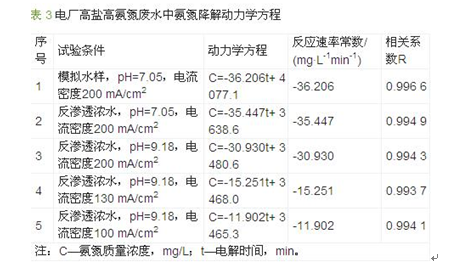
根据氨氮的间接电化学氧化机理,当溶液中存在足量的氯离子条件下,电解生成的有效氯足够与氨氮发生氧化还原反应,反应过程不受有效氯限制。从试验结果看,电解过程中氨氮浓度与电解时间呈近似线性关系,采用一元线性回归对试验数据进行处理,得到各试验条件下氨氮降解的动力学方程、表观反应速率常数及线性相关系数,结果见表 3。从动力学方程看,高盐条件下,氨氮的电化学氧化符合准零级反应动力学规律。
3、结论
(1)所测试的4种钛基金属涂层DSA阳极的析氯电位均满足工业用电解制氯设备技术要求,综合考虑技术、经济指标,选择了析氯电位较低、析氧电位较高的Ti/RuO2-IrO2(R2)电极作为电解除氨氮试验用阳极。
(2)电流密度、极板清洗对氨氮的平均降解速率影响较大,而水样的pH、TDS对氨氮的平均降解速率影响较小。极板清洁度越高,电流密度越大,氨氮的降解越快。对于氨氮初始质量浓度为3 750.4mg/L的水样,当电流密度为200 mA/cm2时,电解约120 min可将氨氮完全去除。
(3)电流密度、水样的pH和TDS对电解能耗有一定影响,TDS越低、电流密度越高、pH越高,氨氮降解平均能耗相对越高,但增长幅度不大;极板清洗对电解能耗影响较大,极板清洁度越高,氨氮降解能耗越低。电解末期平均能耗在0.078~0.119 kW•h/g。
(4)在整个电解过程中,水样中总氯质量浓度缓慢上升并达到约2 000 mg/L后基本不再变化,其中游离氯占总氯比例在20%左右。电解末期当氨氮被全部去除后,总氯浓度快速直线上升,继续进行短时间的电解即可制得总氯质量浓度高于5 000 mg/L的次氯酸钠溶液,达到工业用次氯酸钠产品质量要求,且总氯均以游离氯形态存在。
(5)高盐高氨氮废水的电解除氨氮过程符合准零级反应动力学规律。